你知道Krabbe病吗?Krabbe病怎么治?基因治疗为我们提供了新方向。然而如何掌握基因表达的程度,微小RNA是科学家的一把利剑,能像电灯开关一样调节移植基因的表达程度,这给Krabbe病的患者带来了新希望。
 球形细胞脑白质营养不良,也叫做Krabbe病(亦称Krabbe脑白质营养不良、半乳糖苷酰鞘氨醇脂沉积症、半乳糖脑苷脂β-半乳糖苷水解酶缺失症),是一种常染色体隐性遗传病,因缺乏半乳糖脑苷脂酶(GALC),而造成的半乳糖脑苷脂不能降解成神经酰胺和半乳糖,而蓄积在细胞内,给神经细胞造成毒害。
球形细胞脑白质营养不良,也叫做Krabbe病(亦称Krabbe脑白质营养不良、半乳糖苷酰鞘氨醇脂沉积症、半乳糖脑苷脂β-半乳糖苷水解酶缺失症),是一种常染色体隐性遗传病,因缺乏半乳糖脑苷脂酶(GALC),而造成的半乳糖脑苷脂不能降解成神经酰胺和半乳糖,而蓄积在细胞内,给神经细胞造成毒害。
Krabbe病的病理变化是中枢和外周的脱髓鞘病变,表现为脑白质中有大量球形多核细胞(它们是血源性的巨噬细胞,细胞里充满了未被降解的半乳糖脑苷脂),髓鞘质和少突神经胶质大量丧失;脑白质中星形胶质细胞增生,外周神经通常可见到节段性脱髓鞘变、轴突退行性变、纤维化和巨噬细胞浸润等病变。
临床上可分为两型:
(1)婴儿型,患儿多数在3~6个月时发病,首发症状以易激惹、阵哭、淡漠或呕吐等喂养困难为主,多数伴有营养不良;病情发展迅速,很快即出现进行性躯干和四肢肌张力降低、肌阵挛、腱反射亢进和锥体束征阳性;1岁时即可发生眼震颤、斜视等,随即视神经萎缩、失明;少数患儿听力亦丧失。晚期患儿肌张力亢进,常呈角弓反张,多数在2岁以内死于呼吸困难或肺部感染。
(2)晚发型,约占全部Krabbe病患者的10%~15%。发病年龄自15个月~10岁不等,也可发生在任何年龄的成年人,但多数在5岁以前。临床症状与婴儿型相似,但进展较婴儿型缓慢。初起出现进行性的行走困难,或痉挛性单侧下肢瘫痪或偏瘫,数周或数月后出现双侧锥体束征;半数以上患儿可见腱 反射消失、神经传导速率减低等外周神经被侵犯的征象。随着病程延长,神经系统症状日益加重,由于视神经脱髓鞘变所致的失明常见,患儿或迟或早出现智能衰退和行为异常,但癫痫发作不多见。病程长短不一,多数在起病2~5年后出现四肢瘫痪和痴呆,走向慢性植物人状态,少数人此过程可长达10~20年。
反射消失、神经传导速率减低等外周神经被侵犯的征象。随着病程延长,神经系统症状日益加重,由于视神经脱髓鞘变所致的失明常见,患儿或迟或早出现智能衰退和行为异常,但癫痫发作不多见。病程长短不一,多数在起病2~5年后出现四肢瘫痪和痴呆,走向慢性植物人状态,少数人此过程可长达10~20年。
Krabbe病的实验室特征是:脑脊液中蛋白质含量异常增高;神经传导速率降低;脑部MRI可见脑室周围和顶枕叶部有脱髓鞘病变。
本病发病率约为1/7万~1/10万,因尚缺乏有效的治疗手段,给患者及家属带来了极大的痛苦。目前只有同种异体造血干细胞移植给部分患者带来了希望。然而,最近Gentner及其同事的研究为该病的治疗提供了一个新的方向。
科学家们一直为Krabbe病的治疗而不懈努力。在20世纪90年代早期,同种异体造血干细胞移植就开始用于治疗Krabbe病。这种治疗是基于跨细胞代谢纠正(metabolic cross-correction)的概念,指的是一个缺乏溶酶体酶的细胞可以通过吸收旁边另一个正常细胞的溶酶体酶,从而纠正其功能缺陷。虽然造血干细胞移植对于婴儿型的患者未见疗效,但在晚发型患者身上的结果却是令人鼓舞的。
然而,虽然找到了救命稻草,造血干细胞移植也有其潜在的致病率和死亡率,高剂量的化疗(伴或不伴放疗)、长期的免疫抑制及排异反应等并发症都有极大的副作用,这些大大限制了干细胞移植的应用。但是,跨细胞代谢纠正的可行性和有效性已得到证实,这为把酶输送到外周及中枢神经系统的治疗方案提供了支持。于是,第二种疗法,即静脉输入酶替代疗法(enzyme-replacement therapy, ERT)治疗溶酶体贮积症已经开展了,但该疗法尚不能将足够多的运送到大脑,亦无法达到预期效果。
 于是第三种疗法进入了人们的视线:基因治疗。基因治疗就是利用好的基因来填补或替代基因疾病中某些缺失或病变的基因。人们将好的DNA导入不能编码特定酶的靶细胞中,从而使这些靶细胞能够编码之前所缺乏的酶,相关组织中表达出足够的基因产物,这样就能改变疾病进程。然而直接输入病毒载体到中枢神经系统中具有侵入性,也很可能造成载体分布局限;但静脉输入经过基因校正的自体造血干细胞可以达到广泛的分布,并提供包括中枢神经系统在内的终生酶替代。之前就有人证实了造血干细胞不但能提高红细胞、血小板和白细胞含量,也提高内皮细胞、血管周围巨噬细胞和中枢神经系统的小胶质细胞含量。小胶质细胞具有连续为大脑提供酶的能力,所以经基因校正的小胶质细胞可以长期为外周和中枢神经系统提供所需的酶。这不仅实现了异体造血干细胞移植的优点,又不承担使用免疫抑制剂的潜在风险。并且,相比同种异体干细胞移植,自体干细胞也容易获得。
于是第三种疗法进入了人们的视线:基因治疗。基因治疗就是利用好的基因来填补或替代基因疾病中某些缺失或病变的基因。人们将好的DNA导入不能编码特定酶的靶细胞中,从而使这些靶细胞能够编码之前所缺乏的酶,相关组织中表达出足够的基因产物,这样就能改变疾病进程。然而直接输入病毒载体到中枢神经系统中具有侵入性,也很可能造成载体分布局限;但静脉输入经过基因校正的自体造血干细胞可以达到广泛的分布,并提供包括中枢神经系统在内的终生酶替代。之前就有人证实了造血干细胞不但能提高红细胞、血小板和白细胞含量,也提高内皮细胞、血管周围巨噬细胞和中枢神经系统的小胶质细胞含量。小胶质细胞具有连续为大脑提供酶的能力,所以经基因校正的小胶质细胞可以长期为外周和中枢神经系统提供所需的酶。这不仅实现了异体造血干细胞移植的优点,又不承担使用免疫抑制剂的潜在风险。并且,相比同种异体干细胞移植,自体干细胞也容易获得。
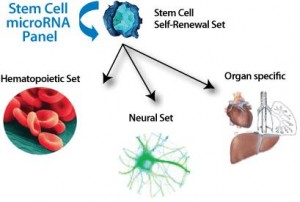
然而,基础研究向临床应用的转换绝非易事。Gentner等人发现半乳糖脑苷脂酶(GALC)基因的强行过度表达对实验鼠和人类的干细胞、早期祖细胞都有害,但对已分化的细胞后代无害,于是提出使用微小RNA(microRNAs)来调节基因的表达。微小RNA是小型的非编码的核糖核酸,可以阻断目标信使RNA的转录或造成它们的直接降解。通过一系列的实验,Gentner发现了一种特别的微小RNA(microRNA),它存在于造血干细胞中,但却没有在已分化的细胞(包括小胶质细胞)中发现。通过将这种微小RNA目标序列链接于GALC编码基因的前面,形成新的构造物,就可以下调GALC的表达(点击查看原图)。
 这种构造物类似于我们家里电灯的开关调节,通过调节功率输出增加或降低电灯的亮度。具体说来是这样的:有时候,我们需要持续的亮光,如同需要GALC在分化了的干细胞后代的高水平表达,为神经细胞提供足够的GALC供给;有时候,我们只需要一点点亮光或不需要亮光,如同希望GALC在造血干细胞中低表达,避免过表达对造血干细胞造成的伤害——这就需要这种微小RNA来进行开关调节。Gentner等人发现,移植了经过遗传修饰、带有这种微小RNA干细胞的实验鼠,大脑的GALC活度增加,并且比对照组的实验鼠活得更长久。
这种构造物类似于我们家里电灯的开关调节,通过调节功率输出增加或降低电灯的亮度。具体说来是这样的:有时候,我们需要持续的亮光,如同需要GALC在分化了的干细胞后代的高水平表达,为神经细胞提供足够的GALC供给;有时候,我们只需要一点点亮光或不需要亮光,如同希望GALC在造血干细胞中低表达,避免过表达对造血干细胞造成的伤害——这就需要这种微小RNA来进行开关调节。Gentner等人发现,移植了经过遗传修饰、带有这种微小RNA干细胞的实验鼠,大脑的GALC活度增加,并且比对照组的实验鼠活得更长久。
综上所述,这些结果为具有调节开关的基因治疗理念提供了证据。虽然其他学者在重复Gentner的实验时遇到了种种困难,比如如何扩大这种技术、在现有条件下生产载体和细胞、以及实施临床试验等。这些都反映了从基础研究到临床应用的本质——正是在不断的遇到问题和解决问题中,基础研究和临床应用在相互提示、相互促进着。
来源:《新英格兰医学杂志》2011-2-10 基础研究的临床意义
Leukodystrophy and Gene Therapy with a Dimmer Switch, Paul J. Orchard, M.D., and John E. Wagner, M.D. N Engl J Med 2011; 364:572-573February 10, 2011
