遗传性心肌病是一类致病机制复杂的疾病,目前研究已经发现了导致各类遗传性心肌病的多个基因位点及相关发病机制,这些机制的阐释对心肌病的治疗提供方向。
遗传性心肌病是各个年龄阶段心脏病的主要原因之一,按照心肌的形态和功能变化可以粗略分为肥厚性心肌病、扩张性心肌病、限制性心肌病、致心律失常型右室心肌病等,通常在青少年期或成年早期发病,给家庭与社会造成沉重负担。起初人们由于不清楚导致心肌病的原因是什么,对治疗这种疾病爱莫能助。直到20年前第一个肥厚性心肌病的致病基因被发现后,研究人员才逐渐了解到这类疾病与遗传基因的密切联系。
随着对心肌病研究的深入,越来越多与遗传性心肌病发病相关的基因被定位出来。虽说既往对许多遗传性疾病的基因研究并没有给治疗带来实质性的突破,但本期NEJM这篇综述《遗传性心肌病》的作者认为,近年来的研究成果已经为心肌病治疗带来了曙光,让我们一起来看看在这个领域都有哪些进展吧!
-
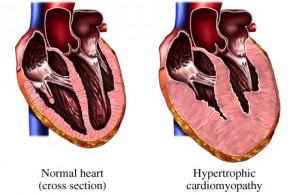
肥厚性心肌病(Hypertrophic cardiomyopathy)
</li> </ul>
故名思议,肥厚性心肌病的特点就是心肌不明原因的显著肥厚(以左心室、室间隔为著),镜下可见心肌排列紊乱及纤维化。心肌病的致病基因最早就发现于肥厚性心肌病,它告诉我们肥厚性心肌病是肌节出了问题。迄今为止共发现有九个编码肌节蛋白的基因出错导致肥厚性心肌病的发生,其中最常见的两个致病基因是MYH7(编码β肌球蛋白重链)和MYBPC3(编码肌球蛋白结合蛋白C,cMyBP-C)。
【基础知识回顾】
-什么是肌节?
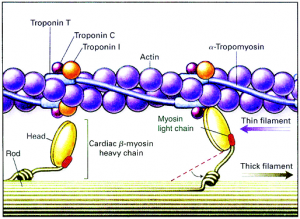
肌节是心肌收缩的基本单位,由粗肌丝(Thick filament)和细肌丝(Thin filament)组成,粗细肌丝间的相互滑动产生了肌节的收缩。
-粗细肌丝是如何发生相对滑动的?
粗肌丝的基本组成单位是肌球蛋白(myosin),它长得就像一棵豆芽,由头(Head)和杆(Rod)组成,头杆连接处可以活动,豆芽头高高翘起于粗肌丝的表面形成横桥,上有ATP酶,可以和ATP结合。细肌丝则由原肌球蛋白(Tropomyosin)、肌动蛋白(Actin)和肌钙蛋白(Troponin)组成,他们三个构成了一个协同运作的整体,当肌钙蛋白与钙离子结合后,原肌球蛋白发生构象改变,暴露出原本被它遮蔽的肌动蛋白上的位点。肌球蛋白的豆芽头和肌动蛋白上的位点结合使ATP酶活化,水解ATP产生能量,横桥发生屈动,从而带动粗细肌丝发生相对滑动。(见下图)
由上可见,肌节的收缩受到肌浆内钙离子的调节。如上两个致病基因的机理就在于它们打破了心肌细胞内正常的钙离子平衡。其一:致病基因编码出的肌节蛋白具有不同一般的动力特性,表现为心肌收缩对钙离子的敏感性与肌钙蛋白对钙离子的亲和力增加,同时横桥数目增加,这使得心肌胞浆的钙离子在舒张期仍保持高浓度,肌节持续收缩;其二:心肌肌节收缩消耗的能量占心肌总耗能的70%,肌节的持续收缩使能耗增加,在总能量有限的情况下,阻碍了心肌其他需要耗能的生理进程,如肌浆网上钙离子泵,它没有足够能量在舒张期将胞浆内钙离子泵回肌浆内质网中,更加重了钙离子在胞浆内的堆积。如此恶性循环,导致心肌舒张障碍。除此之外,其他的一些致病基因还可以通过影响线粒体产能、影响心肌细胞的能量感受器(如AMP活化蛋白激酶)等机制致病。以上这些机制可以产生心肌内异常的信号传导,使心肌发生肥厚。
以上,我们对肥厚性心肌病的致病机制有了比较明确的认识。那怎么治?基于基因研究的治疗方案理所当然更具有针对性。
1 纠正心肌肌浆钙离子失衡。研究肌球蛋白重链突变的老鼠发现,L型钙离子通道拮抗剂地尔硫卓可以预防这些老鼠肌浆网的钙离子失衡和心肌肥厚的发生,目前一项研究地尔硫卓对肥厚性心肌病临床前期病人疗效的II期临床试验正在进行中(ClinicalTrials.gov 编号NCT00319982)。2 改善心肌的能量代谢状态。一项随机临床研究发现,非梗阻性肥厚性心肌病伴有活动受限的患者使用哌克昔林可以改善症状,增加活动耐力。哌克昔林是线粒体肉碱棕榈酰转移酶-1的抑制剂,可以抑制脂肪酸氧化,使心肌更多由葡萄糖代谢产能,增加了心肌的能量供给。3 抑制心肌间质纤维化。肥厚性心肌病还有一个特点就是心肌间质纤维化,这由非心肌细胞(如成纤维细胞)介导的转化生长因子β信号通路活化导致。在大鼠的试验模型中研究人员发现,事先使用血管紧张素II 1型受体拮抗剂可以预防心肌纤维化的发生,这提示着今后治疗研究的另一个方向。
-
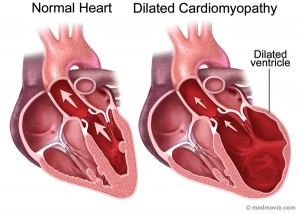
扩张性心肌病(Dilated Cardiomyopathy)
</li> </ul>
扩张性心肌病的表现是心室扩大(左心室为著),收缩功能障碍,心肌细胞死亡和心肌纤维化。相比肥厚性心肌病,扩张性心肌病的基因关联更为复杂,不仅表现为它遗传方式的多样化(常染色体显性、常染色体隐形、X伴性遗传等),更表现为它不仅累及肌节,还涉及心肌细胞的多种生理结构及功能,包括核膜、力传导装置、基因转录修饰机制及钙离子平衡等。
前文已经说到,肥厚性心肌病的基因突变使其心肌收缩对钙离子的敏感性增加,肌钙蛋白对钙离子的亲合力增加。有趣的是,扩张性心肌病的发病机制之一与此正好相反,即在扩张性心肌病中,心肌收缩对钙离子的敏感性下降,肌钙蛋白与钙离子的亲合力降低,导致心肌收缩障碍。然而,它发生这一突变的基因却和肥厚性心肌病一样!这再次体现了心肌病发病机制的复杂性。
关于扩张性心肌病的其他基因异常这里不一一赘述,总之,这些千变万化的异常变化最终导致心肌的自我吞噬和凋亡。由于机制的复杂性,针对性治疗扩张性心肌病要困难得多。
-
致心律失常型右室心肌病(arrhythmogenic right ventricular cardiomyopathy ,ARVC)
这类心肌病的突出表现是右心室心肌的脂肪纤维化和心律失常的发生,目前研究认为它的发病机制和桥粒基因突变有关。桥粒是心肌细胞间相互连接的重要结构,在致心律失常型右室心肌病中,桥粒结构突变削弱了心肌细胞间的连接,降低了心肌细胞对心脏运动产生机械力的承受能力,心肌细胞膜容易受损,致心肌细胞死亡。同时桥粒的变异还可能影响心肌间的缝隙连接,这是心肌电信号传导的重要通路,从而导致心律失常的发生。
然而,这些还都不是关键,更重要的机制是斑珠蛋白(Plakoglobin)对Wnt/β-catenin信号通路的影响。斑珠蛋白是桥粒的重要组分,在桥粒发生变异后会向细胞核内移位,抑制Wnt信号通路的传导,这条通路在心肌细胞的生成中起着重要作用,因而造成心肌细胞生成障碍。再加上其他一些脂质代谢、纤维化相关的信号通路的影响,使心肌发生脂质纤维变。
ARVC的这些发病机制提示,调节心肌的Wnt/β-catenin信号通路及脂质代谢途径可能会成为更具针对性的治疗靶点。
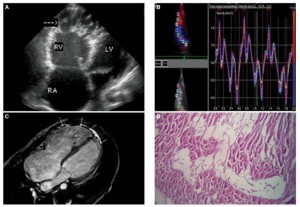
致心律失常型右室心肌病 (A) 经胸壁超声心动图示四腔心,可见右心室扩张及右室心尖部膨出的室壁瘤,伴多发间隔(箭头所示)(B) 组织多普勒速度曲线示收缩期及舒张早期速度减慢,底-中-尖梯度消失(base-mid-apex gradient) (C)MRI心脏长轴图像示右室壁和左室心尖部广泛增强的脂肪信号(箭头所示)(D) 右室壁组织切片染色示心肌细胞被纤维脂肪组织替代(H-E, x100).(点击图像进入原链接)
从临床应用的角度来说,疾病基因研究结果的意义在于能提示特定基因异常与临床表现及治疗的关系。例如,LMNA基因突变的扩张性心肌病患者更容易发生心脏传导疾病,当疾病发展到严重程度时,就需要考虑给患者植入埋藏式心脏复律除颤仪。然而事实远没有那么理想,遗传性心肌病不仅发病机制如此多样,同样的基因异常在不同人身上还会出现不同的表型,或者不发病,或者表现为不同的临床异常,这不仅增加了这类疾病的复杂性,也给治疗带来很大难度。
不过,从以上对三种主要遗传性心肌病发病机制的论述来看,肥厚性心肌病和致心律失常性右室心肌病的治疗导向还比较明确,相信今后的研究会给遗传性心肌病患者带来更多希望。
来源:
新英格兰医学杂志
Review Article
Hugh Watkins, M.D., Ph.D., Houman Ashrafian, B.M., B.Ch., D.Phil., and Charles Redwood, Ph.D.
N Engl J Med 2011; 364:1643-1656April 28, 2011
-
-