“特发性”对于有医学相关背景的人来说都不陌生,几乎所有病因不明的疾病都可以被归结为“特发性XXX”。Stanescu HC的研究则确定了两个和特发性膜性肾病高度相关的等位基因,进一步支持了基因遗传和自身免疫反应在其发病中的作用。
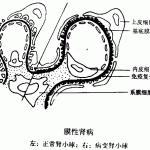 一提到终末期肾病,即常说的尿毒症,人们往往谈虎色变。而特发性膜性肾病所致的肾病综合征,则是导致终末期肾病的主因之一。特发性膜性肾病的年发病率约为十万分之一,主要诊断标准为肾小球有免疫球蛋白及补体复合物的沉积。引起上述免疫反应的两种主要抗原同属于膜糖蛋白:一种为多见于新生儿的中心肽链内切酶(neural endopeptidase),常由于母亲缺少该种酶所致;另一种为M型磷脂酶A2受体(M-type phospholipase A2 receptor, PLA2R1),是在成年特发性膜性肾病患者中发现的第一个抗原。因此,特发性膜性肾病被公认为是一种自身免疫性疾病。那么针对上述抗原的自身抗体从何而来?是否和每个个体的基因序列有千丝万缕的联系?
一提到终末期肾病,即常说的尿毒症,人们往往谈虎色变。而特发性膜性肾病所致的肾病综合征,则是导致终末期肾病的主因之一。特发性膜性肾病的年发病率约为十万分之一,主要诊断标准为肾小球有免疫球蛋白及补体复合物的沉积。引起上述免疫反应的两种主要抗原同属于膜糖蛋白:一种为多见于新生儿的中心肽链内切酶(neural endopeptidase),常由于母亲缺少该种酶所致;另一种为M型磷脂酶A2受体(M-type phospholipase A2 receptor, PLA2R1),是在成年特发性膜性肾病患者中发现的第一个抗原。因此,特发性膜性肾病被公认为是一种自身免疫性疾病。那么针对上述抗原的自身抗体从何而来?是否和每个个体的基因序列有千丝万缕的联系?
 为了解开上述疑惑,Stanescu及其同事使用单核苷酸多态性(single-nucleotide-polymorphism, SNP)技术,对来自三个不同国家(法国、荷兰、英国,均属于白色人种)的特发性膜性肾病患者进行了全基因组研究,结果令人振奋。研究者确认了两个有显著意义的高危等位基因,即染色体2q24位点和染色体6p21位点,分别编码PLA2R1(SNP rs4664308)及HLA-DQα链1(HLA-DQA1)(SNP rs2187688)。其中,HLA-DQA1在三个不同人群中均具有显著性差异。而同时具有上述两种高危等位基因的个体,发生特发性膜性肾病的风险比则高达78.5(95%置信区间,34.6~178.2)。无独有偶,早先分别在中国台湾和韩国进行的针对黄色人种的类似研究发现了另一个高危等位基因PLA2R(SNP rs35771982)。
为了解开上述疑惑,Stanescu及其同事使用单核苷酸多态性(single-nucleotide-polymorphism, SNP)技术,对来自三个不同国家(法国、荷兰、英国,均属于白色人种)的特发性膜性肾病患者进行了全基因组研究,结果令人振奋。研究者确认了两个有显著意义的高危等位基因,即染色体2q24位点和染色体6p21位点,分别编码PLA2R1(SNP rs4664308)及HLA-DQα链1(HLA-DQA1)(SNP rs2187688)。其中,HLA-DQA1在三个不同人群中均具有显著性差异。而同时具有上述两种高危等位基因的个体,发生特发性膜性肾病的风险比则高达78.5(95%置信区间,34.6~178.2)。无独有偶,早先分别在中国台湾和韩国进行的针对黄色人种的类似研究发现了另一个高危等位基因PLA2R(SNP rs35771982)。
可见,不同的人种背后,隐藏着类似的遗传机制。对此,Stanescu等人提出了自己的猜想:HLA-DQ及PLA2R与膜性肾病自身抗体的产生有直接关系—-某PLA2R变异体可以产生与某HLA-DQ变异体具有极强结合力的多肽,进而激活该种HLA-DQ变异体产生自身抗体。但我们知道,无论PLA2R基因的SNP位点发生何种变化,产生的多肽结合力如何强,都不会改变氨基酸的序列,这样如何变异产生自身抗体?虽然其提出了两种可能的解释,但是难以自圆其说。
Segelmark则认为,高危等位基因与膜性肾病自身抗体的产生之间,更可能是一种间接关系,并提出:rs4664308或另一种与其紧密相关的变异体可能会影响某个调控元件,如转录因子结合位点或microRNA基因等,从而控制了自身抗体的产生。该理论在白癜风相关的SNP位点变异中得到了证实,但对于本病,还需要进一步的研究来确定。
尽管针对相关致病机制的争论尚未停息,我们已经有很大的把握确定,PLA2R与膜性肾病之间存在一定的相关性。但是,这距离我们完全摆脱“特发性”这一魔咒仍有很长的一段路要走。新的问题早已摆在眼前—-为什么肾小球上皮细胞会存在PLA2R?一方面,PLA2R的配体—-分泌性磷脂酶A2(secretary phospholipase A2, sPLA2),可以降解细菌细胞膜,是人体抵抗革兰氏阳性细菌的重要武器之一。一旦被激活,中性粒细胞及其他炎症细胞就会向体液中释放大量sPLA2,从而表明,sPLA2可以自由通过肾小球基底膜。而另一方面,sPLA2一旦和PLA2R结合激活,PLA2R就会释放出细胞因子、金属蛋白酶及一氧化氮等。这仍需要进一步的研究来阐述。
来源:《新英格兰医学杂志》2011-2-17 原始论文
Risk HLA-DQA1 and PLA2R1 Alleles in Idiopathic Membranous Nephropathy. Stanescu HC, Arcos-Burgos M, Medlar A, et al. N Engl J Med, 2011; 364: 616-626.
《新英格兰医学杂志》2011-2-17 评论
Genes That Link Nephritis to Autoantibodies and innate Immunity. Segelmark M. N Engl J Med, 2011; 364: 679-680.
