37岁男性,潮红、低血压入院?是变态反应还是毒物作用?还是毫无思路可言?本期MGH病历报道,从潮红、低血压的病生理机制说起,最终锁定肥大细胞增多症,给你一个全面的诊断思路。
【病例】
当日上午,患者出现喷嚏、鼻漏、咽喉不适,之后出现发热。服用OTC阿司匹林、氢溴酸右美沙芬和苯福林重酒石酸盐。30分钟后患者表现出乏力、恶心、上腹痛、面部潮红、并伴两次呕吐,呕吐物为非血性物。后患者跌倒,不伴头部创伤和意识丧失,急诊入院。
患者自述胸膜性胸痛,同时伴弥漫性的腹痛。既往患者间断发作皮肤潮红、结膜充血、呕吐、腹泻12年。上述症状从每年两次加重至每2月一次。体力活动、应激和精神压力使上述症状加重,一般发作时持续约12小时,缓解后的3~4天遗留乏力。外院的检查示收缩压60mmHg ,给予生理盐水治疗。患者既往无其他疾病,无药物过敏史。自述奇异果过敏,过敏反应为喉头水肿和呕吐。患者偶尔饮酒、吸烟,否认违法药物使用史。否认海鲜、病人和特异食物接触史。否认肾病、过敏性疾病、风湿类疾病史。
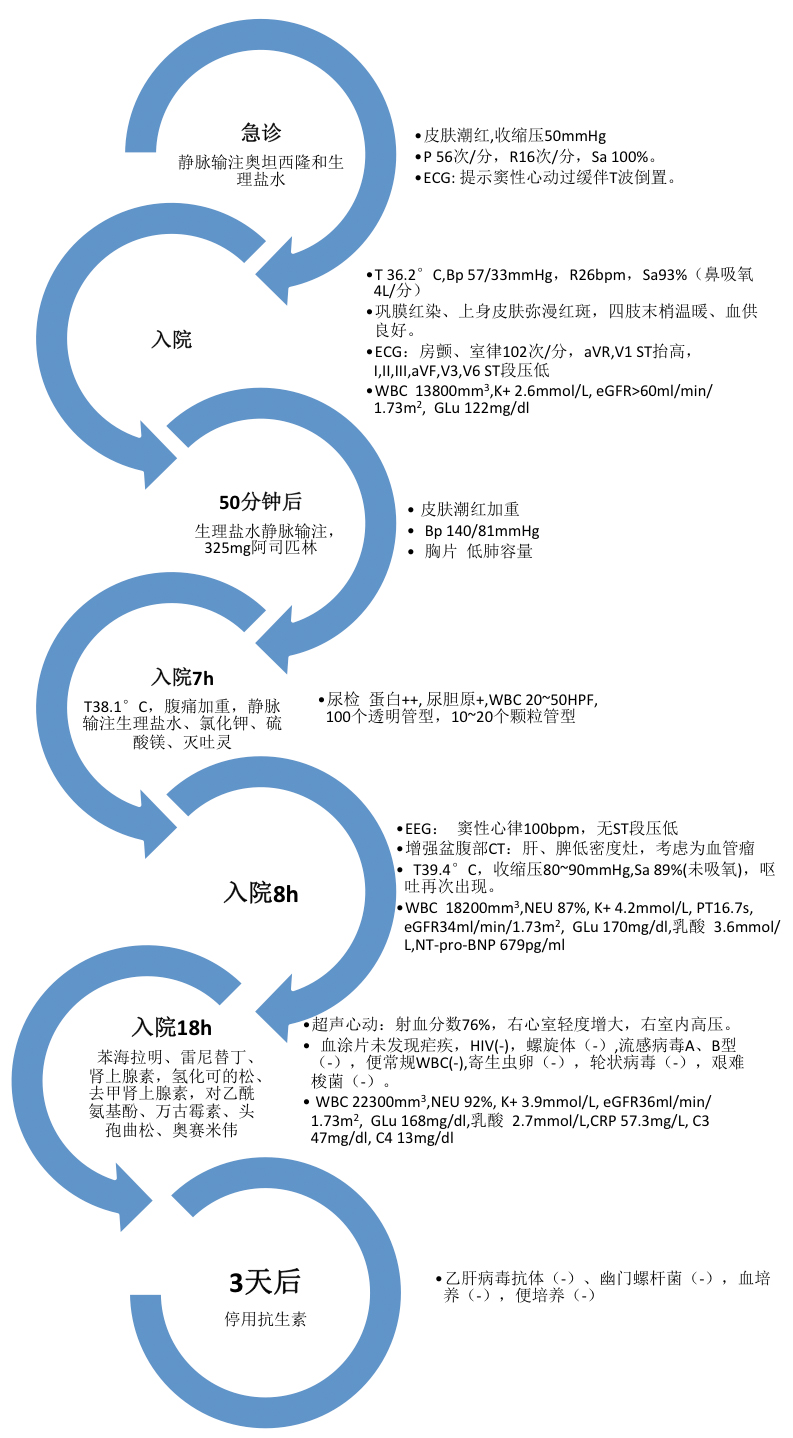
患者自入院以来的临床症状和用药结果详见下图。
分析病人存在的主要问题就在于反复发作的皮肤潮红和低血压,伴乏力和抑郁,应激、阿司匹林会加重上述症状。那么是什么原因导致了病人的潮红呢?潮红主要是由末梢血管扩张,增加了皮肤灌注所致。有两种扩血管的机制:神经源性和扩血管物质性。前者是自主神经作用于血管平滑肌而产生的血管扩张,因为自主神经同时作用于汗腺,所以除了潮红患者往往会伴随出汗。而后者主要为一些扩血管物质如组胺,P物质,PGD2也可以直接作用于血管内皮细胞,从而扩张血管、增加血管通透性,而此种潮红患者往往不伴出汗。组胺可以激活组胺受体H1、H2,扩张血管、增加血管通透性。从而解释了患者的潮红和低血压。而激活H3受体则可以通过局部的神经元-肥大细胞反馈环(neuron-mast-cell feedback loop)产生神经源性血管扩张作用(自主神经作用于血管平滑肌)。常见的可能导致潮红伴低血压的原因可以有外源性因素和内源性因素,外源性因素包括药物性因素(钙通道阻滞剂、血管紧张素转换酶抑制剂等)、食物因素(药物性、毒素)、变态反应;内源性因素包括败血症、类癌综合征、肥大细胞增多症、甲状腺髓样癌、嗜铬细胞瘤。见表1
| 表1.导致血管舒张介导的潮红伴低血压的原因 | |
| 原因 | 分类和特征 |
| 外源性 | |
| 药物 | 烟酸、钙通道阻滞剂、磷酸二酯酶5抑制剂、万古霉素、血管紧张素转换酶抑制剂 |
| 食物 | |
| 药物性 | 辣椒碱、乙醇、亚硫酸盐、谷氨酸钠 |
| 毒物 | |
| 变态反应 | |
| 免疫性 | IgE介导,FcεR1介导;非IgE介导 |
| 非免疫性 | 体力活动、寒冷刺激 |
| 原发、特发 | 无原因 |
| 内源性 | |
| 败血症 | |
| 类癌综合征 | |
| 肥大细胞增多症 | |
| 甲状腺髓样癌 | |
| VIP-分泌肿瘤 | |
| 嗜铬细胞瘤 | |
| 特发性全身毛细性血管渗漏综合征 | |
按照这个思路分析,首先考虑可能的外源因素。那么反复发作的食物、药物或者特发性变态反应是否能解释病人的上述症状呢?已知病人对奇异果过敏,而奇异果与橡胶有相同的抗原,但该患人并无橡胶、奇异果接触史,也并无荨麻疹、神经源性水肿和呼吸道受累的临床表现。因此由特定过敏原所致的过敏反应并不能解释患者的症状。那么特发性变态反应似乎能解释病人的症状,但在诊断前我们需要先除外可能导致上述症状的内源性疾病(败血症、类癌综合征、肥大细胞增多症、甲状腺髓样癌、嗜铬细胞瘤)。
内源因素中,病人无典型嗜铬细胞瘤的表现,甲状腺也未及肿物,因而基本出外了嗜铬细胞瘤和甲状腺髓样细胞癌。而类癌综合征也可以解释潮红和低血压症状,但氨基水杨酸和运动不会加重类癌综合征,也与该患者的症状不附。
肥大细胞增多症时也可出现潮红、低血压同时还伴多系统的受累的表现。β-类胰腺酶是血清类胰蛋白酶的一种,它的水平反映了肥大细胞的激活和脱颗粒。肥大细胞增多症时患者的β-类胰腺酶水平升高,升高的β-类胰腺酶可以增加过敏毒素(C3a,C4a,C5a)的水平,导致变态反应症状。该患者的β-类胰腺酶在发作后的3h时为2983ng/ml(正常值<11.5),同时患者无血象异常、无肝脾肿大,目前考虑为特发性系统性肥大细胞增多症。为进一步诊断还需进一步行骨髓活检和骨穿。
患者的骨髓活检标本富含卵圆核的苍白细胞,这种细胞占骨髓细胞总数的20%。免疫组化的结果发现这些异常细胞上表达了肥大细胞的类胰腺酶和CD117,同时与正常的肥大细胞不同,这些异常细胞还表达了CD25和CD2。骨穿涂片发现在正常的红细胞生成的背景下可以发现异常肥大细胞,表现为胞浆颗粒分布不均的梭形细胞。荧光原位杂交(FISH)未发现Fip1-like 1 nbso gene(FIP1L1)和PDGFRA(platelet-derived growth factor receptor α)的重排,核型分析为正常核型46 XY,聚合酶链反应(PCR)发现了KIT基因上的816位点的突变(Asp-816-Val)。
根据WHO对肥大细胞增多症的定义,系统性肥大细胞增多症的诊断包含主要标准和次要标准。主要标准包括:骨髓中发现聚集的肥大细胞,另有一个非皮肤的器官受累。当主要标准并未完全满足时需要借助次要标准来诊断(满足一条次要标准,当主要标准无一满足时满足次要标准中的3条),次要标准包括:>25%的非典型肥大细胞,表达CD2和CD25的肥大细胞,发现KIT基因816位点的突变,血清总类胰腺酶>20mg/ml。
因而基于上述诊断标准,该患者临床和病理的结果满足了1条主要标准,3条次要标准,最终诊断锁定为系统性肥大细胞增多症。而在诊断时仍然需要进行一些鉴别诊断:首先有30~40%的病人可表现为系统性肥大细胞增多症伴非肥大细胞系克隆性血液疾病(例如骨髓异常综合症)或者急性髓系白血病。这种类型的病人通常可发现KIT基因突变以及增生肥大细胞细胞遗传学的异常,而本病例无形态学相应的改变,核型分析结果也为正常,可除外该亚型诊断。另外,FIP1L1-PDGFRA重排的髓系肿瘤,因为这种总刘也可出现骨髓中的肥大细胞增多,也可出现类胰腺酶水平的升高。而这种类型的肿瘤可以有靶向药物治疗,因而鉴别尤为重要。在本病例中FISH结果出外了FIP1L1-PDGFRA重排。
诊断明确后如何治疗呢?
肥大细胞增多症的治疗主要目的是减轻肥大细胞对机体的负担。针对本病例中的病人治疗原则是避免诱因、使用减少肥大细胞脱颗粒的药物,同时使用相应的阻断剂。具体可以应用组胺受体H1和H2阻断剂、色甘酸钠(阻止肥大细胞脱颗粒)、白三烯受体阻断剂、质子泵抑制剂。
【附】关于肥大细胞增多症
肥大细胞增多症(mastocytosis)是一种肥大细胞在组织(皮肤、骨髓)中病理性的聚集的综合征。WHO根据临床表现和病理表现将该综合症分为7种类型,分别为皮肤型肥大细胞增多症、静止性肥大细胞增多症(Indolent systemic mastocytosis)、系统性肥大细胞增多症伴非肥大细胞系克隆性血液疾病(Systemic mastocytosis with an associated hematologic non−mast-cell lineage disorder)、浸润性系统性肥大细胞增多症(Aggressive systemic mastocytosis)、肥大细胞白血病(Mast-cell leukemia)、皮外肥大细胞瘤(Extracutaneous mastocytoma)、肥大细胞肉瘤(Mast-cell sarcoma)。系统性肥大细胞增多症指的是累积内脏器官(通常指骨髓)的肥大细胞增多症,而这种类型可伴或不伴皮肤受累。
KIT基因:KIT基因编码的是一种跨膜的受体Kit,该受体的细胞外部分可以与干细胞细胞因子(cytokine stem cell factor, SCF)结合,从而激活了前体细胞增殖分化为肥大细胞的过程。而在KIT基因816位点的突变使天冬氨酸被缬氨酸替代,从而导致该受体的持续激活,最终导致肥大细胞的增殖。
症状相关:肥大细胞增多症的临床症状的产生并不是由于肥大细胞的组织浸润,而是肥大细胞的脱颗粒后颗粒中的物质释放到组织中产生的一系列作用。肥大细胞颗粒中包含组胺、各种蛋白酶(类胰蛋白酶、糜蛋白酶)、蛋白多糖(肝素、硫酸软骨素)。其中的血管活性物质(组胺、LTC4、PGD2)作用于局部或者远端组织导致血管扩张,从而导致潮红、心动过速、低血压、晕厥。组胺还能导致皮肤的紫癜表现和壁细胞的胃酸高分泌状态。肥大细胞中还富含各种细胞因子,肥大细胞被破坏后释放到组织中的肿瘤坏死因子(TNF-α)和白细胞介素-6(IL-6)可能与病理性的乏力和骨质疏松相关。
参考资料:
1.《新英格兰医学杂志》MGH病例报道
Mandakolathur R. Murali, M.D.,etc. A 37-Year-Old Man with Flushing and Hypotension,N Engl J Med 2011;364:1155-65.
- William P.Arend,MD,(2007),Goldman:Cecil Medicine,23rd ed. chapter 276.
We temporarily repaired the faulty drive, imaged all 4 drives and recovered all of the file recovery in 7 days.